图中A~F是初中化学常见的物质,A俗称苏打:B可用于改良酸性土壤:C可用作补钙剂:E、F的物质类别相同。图中“一”表示两端的物质间能发生化学反应:“→”表示物质间存在转化关系:反应条件、部分反应物和生成物已略去。请回答:
(1)物质A的用途有 (只需填写一条)。
(2)物质D的化学式 。
(3)写出下列反应的化学方程式:
①E转化为B ,
②C转化为F 。
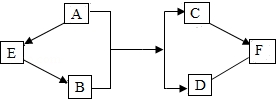
图中A~F是初中化学常见的物质,A俗称苏打:B可用于改良酸性土壤:C可用作补钙剂:E、F的物质类别相同。图中“一”表示两端的物质间能发生化学反应:“→”表示物质间存在转化关系:反应条件、部分反应物和生成物已略去。请回答:
(1)物质A的用途有 (只需填写一条)。
(2)物质D的化学式 。
(3)写出下列反应的化学方程式:
①E转化为B ,
②C转化为F 。
