如图是干电池的截面示意图.废旧电池也是资源,将其回收利用对保护环境具有重要意义,请结合图示回答下列问题
(1)碳棒(主要成分是石墨)用作电极,是利用石墨的 性.
2444Cl还可作化肥使用,属于化肥中的 肥,其中氮元素的化合价是 .
(3)干电池中含有金属铜和锌.以下能证明Cu、Zn金属活动性强弱的实际组合是 (填序号).
A.锌、铜和稀硫酸 B.锌和氯化铜溶液 C.铜和硫酸锌溶液.
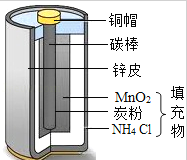
如图是干电池的截面示意图.废旧电池也是资源,将其回收利用对保护环境具有重要意义,请结合图示回答下列问题
(1)碳棒(主要成分是石墨)用作电极,是利用石墨的 性.
2444Cl还可作化肥使用,属于化肥中的 肥,其中氮元素的化合价是 .
(3)干电池中含有金属铜和锌.以下能证明Cu、Zn金属活动性强弱的实际组合是 (填序号).
A.锌、铜和稀硫酸 B.锌和氯化铜溶液 C.铜和硫酸锌溶液.
