已知A﹣F是初中化学常见的物质,B在农业上常用于改良酸性土壤,C是胃酸的主要成分,它们之间的转化关系如图所示.("→"表示由一种物质可以转化为另一种物质,"﹣"表示相邻的物质间可以相互反应,其中部分反应物和生成物及反应条件已略去).
请回答下列问题:
(1)A的化学式为 ;
(2)物质C的一种用途为 ;
(3)D和F反应的基本类型为 ;
(4)B和E反应的化学方程式为 (写一个即可).
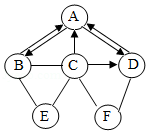
已知A﹣F是初中化学常见的物质,B在农业上常用于改良酸性土壤,C是胃酸的主要成分,它们之间的转化关系如图所示.("→"表示由一种物质可以转化为另一种物质,"﹣"表示相邻的物质间可以相互反应,其中部分反应物和生成物及反应条件已略去).
请回答下列问题:
(1)A的化学式为 ;
(2)物质C的一种用途为 ;
(3)D和F反应的基本类型为 ;
(4)B和E反应的化学方程式为 (写一个即可).
