请按要求回答下列问题。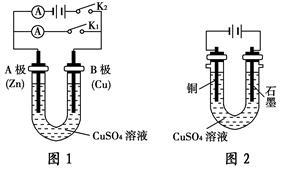
(1)根据图1回答①②:①打开K2,闭合K1。A极现象________,B极的电极反应式为______________________。
②打开K1,闭合K2。A极可观察到的现象是__________________________。
(2)根据图2回答③④:③电解反应的离子方程式为___________________。
④实验完成后,铜电极增重ag,石墨电极产生标准状况下的气体体积________L。
请按要求回答下列问题。
(1)根据图1回答①②:①打开K2,闭合K1。A极现象________,B极的电极反应式为______________________。
②打开K1,闭合K2。A极可观察到的现象是__________________________。
(2)根据图2回答③④:③电解反应的离子方程式为___________________。
④实验完成后,铜电极增重ag,石墨电极产生标准状况下的气体体积________L。