下面几组物质,请将合适组号填写在下表中。
① 和
和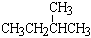 ;②
;② 和
和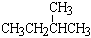 ;③CH4和CH3CH2CH3;④金刚石与石墨;⑤氕、氘与氚;⑥16O、17O和18O;⑦乙醇(CH3CH2OH)和二甲醚(CH3OCH3);⑧氧气(O2)与臭氧(O3)。
;③CH4和CH3CH2CH3;④金刚石与石墨;⑤氕、氘与氚;⑥16O、17O和18O;⑦乙醇(CH3CH2OH)和二甲醚(CH3OCH3);⑧氧气(O2)与臭氧(O3)。
| 类别 |
同位素 |
同系物 |
同素异形体 |
同分异构体 |
| 组号 |
|
|
|
|
下面几组物质,请将合适组号填写在下表中。
① 和
和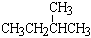 ;②
;② 和
和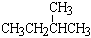 ;③CH4和CH3CH2CH3;④金刚石与石墨;⑤氕、氘与氚;⑥16O、17O和18O;⑦乙醇(CH3CH2OH)和二甲醚(CH3OCH3);⑧氧气(O2)与臭氧(O3)。
;③CH4和CH3CH2CH3;④金刚石与石墨;⑤氕、氘与氚;⑥16O、17O和18O;⑦乙醇(CH3CH2OH)和二甲醚(CH3OCH3);⑧氧气(O2)与臭氧(O3)。
| 类别 |
同位素 |
同系物 |
同素异形体 |
同分异构体 |
| 组号 |
|
|
|
|