火力发电厂释放出大量氮氧化物(NOx)、SO2和CO2等气体会造成环境问题。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g) + 4NO2(g) =4NO(g) + CO2(g) + 2H2O(g)△H1=-574 kJ·mol-1
CH4(g) + 4NO(g) =2N2(g) + CO2(g) + 2H2O(g)△H2=-1160 kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为。
(2)脱碳。将CO2转化为甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H3
CH3OH(g)+H2O(g)△H3

①在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2进行上述反应。测得CO2和CH3OH(g)浓度随时间变化如图1所示。回答:0~10 min内,氢气的平均反应速率为mol/(L·min);第10 min后,保持温度不变,向该密闭容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡(填“正向”、“逆向”或“不”)移动。
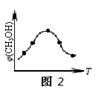
②取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇的反应的△H30(填“>”、“<”或“=”)。
(3)脱硫。利用Na2SO3溶液可脱除烟气中的SO2。Na2SO3可由NaOH溶液吸收SO2制得。NaOH溶液吸收SO2的过程中,pH随n(SO32-)︰n(HSO3﹣)变化关系如下表:
n(SO32﹣)︰n(HSO3﹣)
|
91︰9
|
1︰1
|
9︰91
|
pH
|
8.2
|
7.2
|
6.2
|
① 由上表判断,NaHSO3溶液显 性,用化学平衡原理解释: 。
② 当溶液呈中性时,离子浓度关系正确的是(选填字母): 。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+) > c(HSO3-) > c(SO32-) > c(H+) = c(OH-)
c.c(Na+) + c(H+) = c(SO32-) + c(HSO3-) + c(OH-)