硫及其化合物有广泛应用。
(1)硫酸生产过程中涉及以下反应。已知25℃、l0l kPa时:
①2SO2(g)+O2(g)+2H2O(l)=2H2SO4(l) ΔH=-457kJ/mol
②SO3(g) +H2O(l)=H2SO4(l) ΔH=-130kJ/mol
则SO2催化氧化为SO3(g)的热化学方程式为__________________。
(2)对于SO3催化氧化为SO3的反应。
①甲图是SO2(g)和SO3(g)的浓度随时间的变化情况。反应从开始到达到平衡时,用O2表示的平均反应速率为________________。
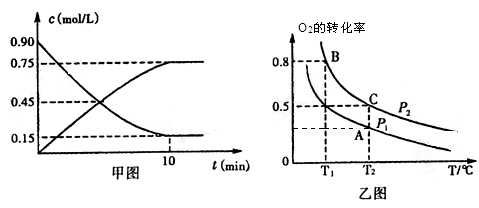
②在一容积可变的密闭容器中充入20mol SO2(g)和l0 mol O2(g),O2的平衡转化率随温度(T)、压强(P)的变化如图乙所示。则P1与P2的大小关系是P1________________ P2(填>、=或<);A、B、C三点的平衡常数大小关系为____________(用KA、KB、KC和 >、=、<表示),理由是______________________。
(3)工业生成硫酸过程中,通常用氨水吸收尾气。①如果在25℃时,相同物质的量的SO2与NH3溶于水,发生反应的离子方程式为__________,所得溶液中c(H+)-c(OH-)=___________(填序号)。
A.c(SO32-)-c(H2SO3)
B.c(HSO3-)+c(SO32-)-c(NH4+)
C.c(SO32-)+c(NH3∙H2O)-c(H2SO3)
D.c(HSO3-)+2c(SO32-)-c(NH4+)
②已知在25℃时NH3·H2O、H2SO3电离平衡常数如下表,则上述所得溶液中各离子浓度由大到小的顺序为_____________________。
| |
NH3·H2O |
H2SO3 |
|
| 电离平衡常数(mol/L) |
1.7×10-5 |
Ka1 |
Ka2 |
| 1.54×10-2 |
1.02×10-7 |
 CH3OH(g)
CH3OH(g)
 减小
减小
 2HX(g) (X2表示Cl2、Br2和I2)。下图表示平衡常数K与温度T的关系。
2HX(g) (X2表示Cl2、Br2和I2)。下图表示平衡常数K与温度T的关系。
 H表示X2与H2反应的晗变,H0。(填“>”、“<”或“=”)
H表示X2与H2反应的晗变,H0。(填“>”、“<”或“=”)

 +↑。
+↑。 Cu+Cu2+,试分析CuAlO2分别与足量盐酸、稀硝酸混合后,产生现象的异同点。
Cu+Cu2+,试分析CuAlO2分别与足量盐酸、稀硝酸混合后,产生现象的异同点。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号