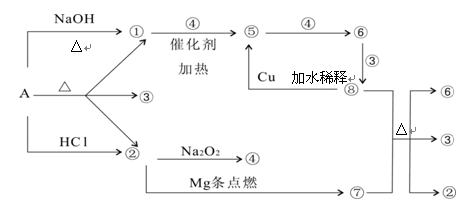
正盐A能发生下图所示的反应,图中①~⑧分别代表有关反应中的一种物质(某些物质已略去),其中①、②、④、⑤为无色气体。
请完成下列各题:
(1)写出化学式A ⑥ ⑦
(2)写出下列反应方程式:
⑧+⑦ ②+③+⑥:
②+③+⑥:
①+④ ⑤:
⑤:
(3)⑧ ⑤的离子方程式为:
⑤的离子方程式为:
正盐A能发生下图所示的反应,图中①~⑧分别代表有关反应中的一种物质(某些物质已略去),其中①、②、④、⑤为无色气体。

请完成下列各题:
(1)写出化学式A ⑥ ⑦
(2)写出下列反应方程式:
⑧+⑦ ②+③+⑥:
②+③+⑥:
①+④ ⑤:
⑤:
(3)⑧ ⑤的离子方程式为:
⑤的离子方程式为: