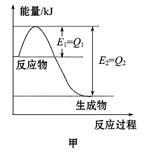
Ⅰ.图甲是在一定温度和压强下N2和H2反应生成1 mol NH3过程中能量变化示意图,请写出工业合成氨的热化学方程式(ΔH的数值用含字母Q1、Q2的代数式表示): 。
Ⅱ.(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应,
已知:N2(g)+3H2(g) 2NH3(g) ΔH="-92.4" kJ·mol-1,
2NH3(g) ΔH="-92.4" kJ·mol-1,
2H2(g)+O2(g)====2H2O(l) ΔH="-571.6" kJ·mol-1,
则2N2(g)+6H2O(l) 4NH3(g)+3O2(g) ΔH= ;
4NH3(g)+3O2(g) ΔH= ;
(2)在微生物作用的条件下,NH4+经过两步反应被氧化成NO。两步反应的能量变化示意图如下:
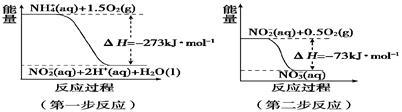
①第一步反应是________反应(填“放热”或“吸热”),判断依据是______________________________________。
②1 mol NH4+ (aq) 全部氧化成NO3-(aq)的热化学方程式是__ ________。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号