实验室欲配制480 mL 0.1 mol•L-1 Na2CO3溶液,请据此回答下列问题:
(1)实验时,应用托盘天平称取Na2CO3·10H2O晶体 g。
(2)在配制Na2CO3溶液时需用的玻璃仪器主要有量筒、烧杯、玻璃棒、 、 。
(3)若实验过程中遇到下列情况,则会造成所配溶液的浓度偏低的是 。(填字母)
| A.容量瓶内壁附有水珠而未干燥处理 |
| B.忘记将洗涤液加入容量瓶 |
| C.定容时俯视刻度线 |
| D.摇匀后发现液面低于刻度线,加水至凹液面恰好与刻度线相切 |


 ZnSO4+SO2↑+2H2O制取22.4 L(标准状况)SO2气体。取65.0 g锌粒与98%的浓H2SO4(ρ=1.84 g·cm-3)110 mL充分反应,锌全部溶解。对于制得的气体,有同学认为可能混有氢气。为此,化学小组的同学设计了如下实验装置,对所制取的气体进行探究。
ZnSO4+SO2↑+2H2O制取22.4 L(标准状况)SO2气体。取65.0 g锌粒与98%的浓H2SO4(ρ=1.84 g·cm-3)110 mL充分反应,锌全部溶解。对于制得的气体,有同学认为可能混有氢气。为此,化学小组的同学设计了如下实验装置,对所制取的气体进行探究。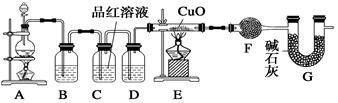

 粤公网安备 44130202000953号
粤公网安备 44130202000953号