(1)在常温下,发生下列几种反应:
①16H++10Z-+2XO4-===2X2++5Z2+8H2O
②2A2++B2===2A3++2B- ③2B-+Z2===B2+2Z-
根据上述反应,XO4-、Z2、B2、A3+氧化性从强到弱的顺序为:
(2)已知KMnO4与浓盐酸发生如下反应:
2KMnO4 + 16HCl(浓) ="==" 2KCl + 2MnCl2 + 5Cl2↑+8H2O。
在上述反应中,氧化产物和还原产物物质的量之比是 。用单线桥法标出此反应的电子转移方向和数目 。
(3)有下列6种物质:K2SO4、K2SO3、I2、H2SO4、KIO3、H2O组成一个氧化还原反应,已知在反应中K2SO3失去电子。请回答下列问题:
①将这6种物质分别填入下面对应的横线上,组成一个配平的化学方程式:
________+________+ H2SO4→ ________+________+________(填化学式)
②反应中1mol氧化剂得到______mol电子。
 原性HSO3->I-,氧化性IO3-> I2 > SO42-。
原性HSO3->I-,氧化性IO3-> I2 > SO42-。
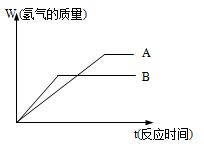
 ) 两种金属的活动性顺序是_____>______
) 两种金属的活动性顺序是_____>______
 应的离子方程式:①+②__________________________。
应的离子方程式:①+②__________________________。 粤公网安备 44130202000953号
粤公网安备 44130202000953号