(12分)
在盛有AgNO3、HCl、Na2CO3、CaCl2、NaCl五种无色溶液的试剂瓶上,分别贴有①~⑤的编号。将它们两两混合,产生的现象如表所列(其中“↑”表示产生气体,“↓”表示生成沉淀,“—”表示无现象):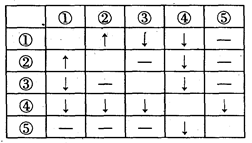
(1)写出③、④、⑤三种物质的化学式为:
③______________,④_____________,⑤_______________。
(2)写出下列反 应的离子方程式:①+②__________________________。
应的离子方程式:①+②__________________________。
(12分)
在盛有AgNO3、HCl、Na2CO3、CaCl2、NaCl五种无色溶液的试剂瓶上,分别贴有①~⑤的编号。将它们两两混合,产生的现象如表所列(其中“↑”表示产生气体,“↓”表示生成沉淀,“—”表示无现象):
(1)写出③、④、⑤三种物质的化学式为:
③______________,④_____________,⑤_______________。
(2)写出下列反 应的离子方程式:①+②__________________________。
应的离子方程式:①+②__________________________。