Ⅰ。一定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验。某研究性学习小组在实验室中配制1mol/L的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是______________(答案可能不唯一)
| A.实验中所用到的滴定管、容量瓶,在使用前均需要检漏; |
| B.如果实验中需用60mL 的稀硫酸标准溶液,配制时应选用100mL容量瓶; |
| C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小; |
| D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大; |
E、用甲基橙作指示剂,滴定终点时,溶液颜色从橙色变为红色;
F、配制溶液和中和滴定的两个实验中,若在最后一次读数均俯视读数,则导致实验结果都偏大。
Ⅱ . 现用如图所示的装置制取较多量的饱和氯水并测定饱和氯水的pH。
回答有关问题:
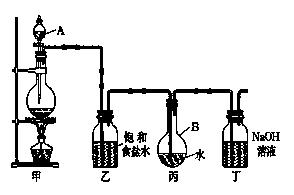
(1)写出有关化学方程式。
装置甲:____________________________________ ;
装置丁:__________________。
(2)证明氯水已饱和的现象是。
(3)制取结束时,装置丙的液体中含有的微粒是(用 微粒符号表示 );
微粒符号表示 );
(4)若撤去装置乙,直接将装置甲和丙相连。这样做对实验测定结果的影响是:。
测定饱和氯水的pH方法是_______________________________________________。
Ⅲ.实验设计:证明NaOH固体在空气中放置部分变质
_______________________________________________________________
 _______________________________________________________________________
_______________________________________________________________________




 ①准确取出的浓NaOH溶液在空气中露置时间过长;
①准确取出的浓NaOH溶液在空气中露置时间过长; ②用量器将浓NaOH溶液直接加入容量瓶,缓慢加入蒸馏水至液面最低点恰好和环形刻度线相切;
②用量器将浓NaOH溶液直接加入容量瓶,缓慢加入蒸馏水至液面最低点恰好和环形刻度线相切;


 ________________________________________________________。
________________________________________________________。


 微粒符号表示 );
微粒符号表示 ); _______________________________________________________________________
_______________________________________________________________________
 粤公网安备 44130202000953号
粤公网安备 44130202000953号