有一澄清透明的溶液,可能大量存在有NH4+、Fe3+、H+、Mg2+、A13+、I-、CO32-等离子。现分别取溶液进行下列实验:
(1)加人淀粉溶液,未见蓝色。
(2)加人少量AgNO3溶液有黄色沉淀和气体生成。
(3)逐滴加人1mol·L-1NaOH溶液,随着NaOH溶液的滴人,产生沉淀的量如图所示。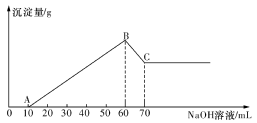
试确定:溶液中一定不存在的离子有________,其中阴离子物质的量为_________,加人少量AgNO3溶液的离子反应方程式为________________。
有一澄清透明的溶液,可能大量存在有NH4+、Fe3+、H+、Mg2+、A13+、I-、CO32-等离子。现分别取溶液进行下列实验:
(1)加人淀粉溶液,未见蓝色。
(2)加人少量AgNO3溶液有黄色沉淀和气体生成。
(3)逐滴加人1mol·L-1NaOH溶液,随着NaOH溶液的滴人,产生沉淀的量如图所示。
试确定:溶液中一定不存在的离子有________,其中阴离子物质的量为_________,加人少量AgNO3溶液的离子反应方程式为________________。