现有14.4 g CO和CO2的混合气体,在标准状况下其体积为8.96 L。回答下列问题:
(1)该混合气体的平均摩尔质量为________。
(2)混合气体中碳原子的个数为________(用NA表示阿伏加德罗常数的值)。
(3)将混合气体依次通过下列如图所示装置,最后收集在气球中(实验在标准状况下测定)。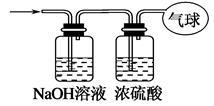
①气球中收集到的气体的摩尔质量为________。
②气球中收集到的气体中,电子总数为_____(用NA表示阿伏加德罗常数的值)。
③气球的体积为________L。
现有14.4 g CO和CO2的混合气体,在标准状况下其体积为8.96 L。回答下列问题:
(1)该混合气体的平均摩尔质量为________。
(2)混合气体中碳原子的个数为________(用NA表示阿伏加德罗常数的值)。
(3)将混合气体依次通过下列如图所示装置,最后收集在气球中(实验在标准状况下测定)。
①气球中收集到的气体的摩尔质量为________。
②气球中收集到的气体中,电子总数为_____(用NA表示阿伏加德罗常数的值)。
③气球的体积为________L。