硫代硫酸钠(Na2S2O3·5H2O)俗名“大苏打”,又称为“海波”,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等。它易溶于水,难溶于乙醇,加热、易分解,在酸性溶液中不能稳定存在。工业上常用亚硫酸钠法、硫化碱法等制备。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如下图:
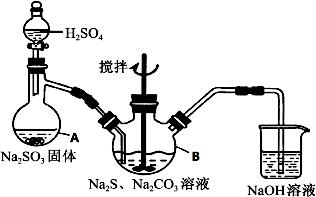
实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液的滴速,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸。
②直至析出的浑浊不再消失,并控制溶液的pH接近7时,停止通入SO2气体。
③趁热过滤,将滤液加热浓缩,冷却析出Na2S2O3·5H2O。
④再经过滤、洗涤、干燥,得到所需的产品。
(1)步骤④中洗涤时,为了减少产物的损失用的试剂可以是 。
(2)为了保证硫代硫酸钠的产量,实验中不能让溶液pH<7,请用离子方程式表示原因 。
(3)写出三颈烧瓶B中制取Na2S2O3反应的总化学反应方程式 。
(4)常用Na2S2O3溶液测定废水中Ba2+ 浓度,步骤如下:取废水25.00mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时全部转化为Cr2O72-;再加过量KI溶液,充分反应后得混合溶液VmL,将其平均分成4等份,加入淀粉溶液作指示剂,用0.0010 mol.L-1的Na2S2O3溶液进行滴定,反应完全时,相关数据记录如下表所示:
| 编号 |
1 |
2 |
3 |
4 |
| 消耗Na2S2O3标准溶液的体积/mL |
18.02 |
17.98 |
18.00 |
20.03 |
部分反应离子方程式为:
① Cr2O72-+6I-+14H+ 2Cr3++3I2+7H2O; ②I2+2S2O32-
2Cr3++3I2+7H2O; ②I2+2S2O32- 2I-+S4O62-。
2I-+S4O62-。
①判断达到滴定终点的现象是__ _____________
②从表格所给数据计算:一份待测溶液消耗Na2S2O3溶液的平均体积为 ml
③废水中Ba2+的物质的量浓度__________________。
(5)Na2S2O3常用作脱氯剂,在溶液中易被Cl2氧化成SO42-,该反应的离子方程式为_________________。
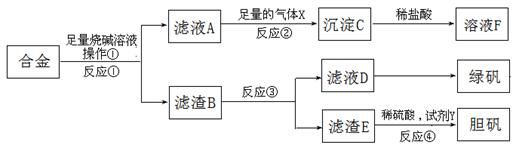


 设计一种实验方案证明Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否由Na2SO4生成,他们设计了如下方案:
设计一种实验方案证明Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否由Na2SO4生成,他们设计了如下方案:
 _,将溶液转入________中,洗涤,定容,摇匀。
_,将溶液转入________中,洗涤,定容,摇匀。 填“能”或“不能”)配制1.0 mol·L-1 Ba(OH)2溶液。
填“能”或“不能”)配制1.0 mol·L-1 Ba(OH)2溶液。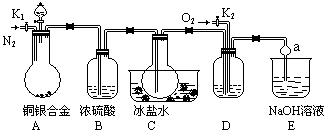
 粤公网安备 44130202000953号
粤公网安备 44130202000953号