现有含NaCl、Na2SO4和NaNO3的混合溶液,选择适当的试剂除去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液.相应过程用如图表示: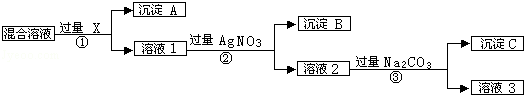
(1)写出下列物质的化学式X__________;
(2)写出步骤③涉及到的离子反应__________,__________;
(3)按此实验方案得到的溶液3中肯定含有杂质,为了解决这个问题,可以向溶液3中加入适量的__________(填化学式),之后若要获得固体NaNO3需进行的实验操作是__________(填操作名称).
现有含NaCl、Na2SO4和NaNO3的混合溶液,选择适当的试剂除去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液.相应过程用如图表示:
(1)写出下列物质的化学式X__________;
(2)写出步骤③涉及到的离子反应__________,__________;
(3)按此实验方案得到的溶液3中肯定含有杂质,为了解决这个问题,可以向溶液3中加入适量的__________(填化学式),之后若要获得固体NaNO3需进行的实验操作是__________(填操作名称).