在400℃时,将一定量SO2和14molO2投入一个盛有催化剂的10L密闭容器中进行反应2SO2+O2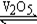 2SO3,已知2min后容器中剩余2molSO2和12molO2,则:
2SO3,已知2min后容器中剩余2molSO2和12molO2,则:
(1)生成了_______ mol SO3, SO2起始物质的量的浓度是________ mol/L―1。
(2)V(SO2)是_______ mol/L―1.min―1, V(SO3)是_________ mol/L―1.S―1。
在400℃时,将一定量SO2和14molO2投入一个盛有催化剂的10L密闭容器中进行反应2SO2+O2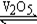 2SO3,已知2min后容器中剩余2molSO2和12molO2,则:
2SO3,已知2min后容器中剩余2molSO2和12molO2,则:
(1)生成了_______ mol SO3, SO2起始物质的量的浓度是________ mol/L―1。
(2)V(SO2)是_______ mol/L―1.min―1, V(SO3)是_________ mol/L―1.S―1。