硫酸工业中SO2转化为SO3是重要的反应之一,在一定压强和催化剂作用下在2L密闭容器中充入0.8molSO2和2molO2发生反应:2SO2(g)+O2(g)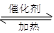 2SO3(g),SO2的转化率随温度的变化如下表所示:
2SO3(g),SO2的转化率随温度的变化如下表所示:
温度
|
450
|
475
|
500
|
525
|
550
|
575
|
600
|
650
|
SO2的转化率%
|
97.5
|
95.8
|
95.8
|
93.5
|
90.50
|
85.6
|
80.0
|
73.7
|
(1)由表中数据判断△H0(填“>”、“=”或“<”)
(2)能判断该反应是否达到平衡状态的是
A. 容器的压强不变 B. 混合气体的密度不变
C. 混合气体中SO3的浓度不变 D. C(SO2)=C(SO3)
E. v正(SO2)=v正(SO3) F. v正(SO3)=2v逆(O2)
(3)某温度下经2min反应达到平衡后C(SO2)=0.08mol·L-1.
①0~2min之间,O2的反应速率为.
②此时的温度为 .③此温度下的平衡常数为(可用分数表示).
.③此温度下的平衡常数为(可用分数表示).
④若将平衡反应混合物的压强增大1倍(假如体积可变),此时Qc为,平衡将向移动。