七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1部分阳离子以氢氧化物形式完全沉淀时溶液的pH
沉淀物
|
Al(OH)3
|
Fe(OH)3
|
Fe(OH)2
|
Mn(OH)2
|
Mg(OH)2
|
pH值
|
5.2
|
3.2
|
9.7
|
10.4
|
11.2
|
表2两种盐的溶解度(单位为g/100g水)
温度/℃
|
10
|
30
|
40
|
50
|
60
|
CaSO4
|
0.19
|
0.21
|
0.21
|
0.20
|
0.19
|
MgSO4·7H2O
|
30.9
|
35.5
|
40.8
|
45.6
|
/
|
硼镁泥制取七水硫酸镁的工艺流程如下:
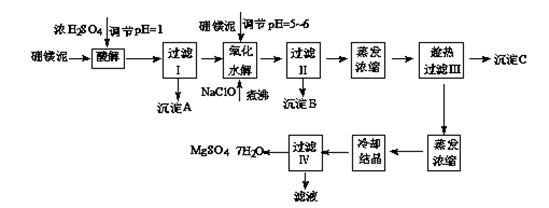
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为。加热煮沸的主要目的是。
(2)沉淀B中除MnO2、SiO2外还含有(填化学式)等物质。
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是;
(4)沉淀C的化学式是。过滤III需趁热过滤的理由是