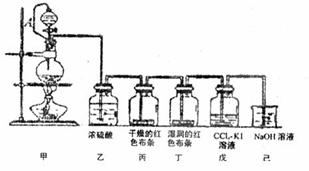
甲、乙两个小组利用酸性KMnO4与H2C2O4溶液反应,设计实验探究影响反应速率的因素(2MnO4- + 5H2C2O4+ 6H+=2Mn2+ +10CO2+8H2O)
甲组:利用右图装置,通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小。(实验中所用KMnO4溶液均已加入H2SO4)

| 序号 |
A溶液 |
B溶液 |
| ① |
2ml 0.2mol/LH2C2O4溶液 |
4ml 0.01mol/LKMnO4溶液 |
| ② |
2ml 0.1mol/LH2C2O4溶液 |
4ml 0.01mol/LKMnO4溶液 |
| ③ |
2ml 0.2mol/LH2C2O4溶液 |
4ml 0.01mol/LKMnO4溶液和少量MnSO4 |
(1)该实验的目的是探究 对化学反应速率的影响。
(2)分液漏斗中A溶液应该 加入(填“一次性”或“逐滴滴加”)
(3)实验结束后,读数前为了使两个量气管的压强相等,避免产生压强差,影响测定结果,需要进行的操作是 。
乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率
为了探究KMnO4与H2C2O4浓度对反应速率的影响,某同学在室温下完成以下实验
| 实验编号 |
1 |
2 |
3 |
4 |
| 水/ml |
10 |
5 |
0 |
X |
| 0.5 mol/L H2C2O4/ml |
5 |
10 |
10 |
5 |
| 0.2 mol/L KMnO4/ml |
5 |
5 |
10 |
10 |
| 时间/s |
40 |
20 |
10 |
--- |
(4)X=
A.5 B.10 C.15 D.20
4号实验中始终没有观察到溶液褪色,你认为可能的原因是 。
 橡皮管,针头已插入并穿过橡皮塞)进行教学。试回答下列问题:
橡皮管,针头已插入并穿过橡皮塞)进行教学。试回答下列问题:


 ,rX(A)表示物质A物理量(如质量、浓度等)的改变量。某学习小组用块状纯锌和200mL稀硫酸反应研究化学反应速率,实验装置图如右图。
,rX(A)表示物质A物理量(如质量、浓度等)的改变量。某学习小组用块状纯锌和200mL稀硫酸反应研究化学反应速率,实验装置图如右图。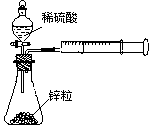



 粤公网安备 44130202000953号
粤公网安备 44130202000953号