下图是配制50 mL KMnO4标准溶液的过程示意图。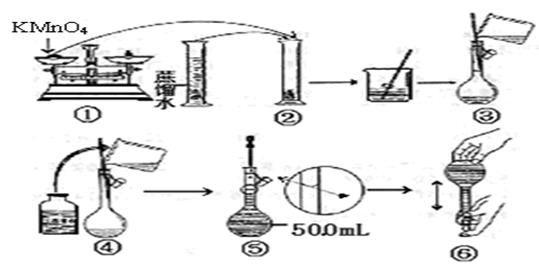
(1)请你观察图示判断其中不正确的操作有(填序号)____________;
(2)其中确定50mL溶液体积的容器是(填名称)__________________;
(3)如果用上述操作所配制的KMnO4溶液与未知浓度的草酸溶液进行实验,2KMnO4+ 5H2C2O4 + 3H2SO4= 2MnSO4 + 10CO2 + 8H2O,在其他操作均正确的情况下,所测得草酸溶液的浓度将____________(填偏大或偏小)。
下图是配制50 mL KMnO4标准溶液的过程示意图。
(1)请你观察图示判断其中不正确的操作有(填序号)____________;
(2)其中确定50mL溶液体积的容器是(填名称)__________________;
(3)如果用上述操作所配制的KMnO4溶液与未知浓度的草酸溶液进行实验,2KMnO4+ 5H2C2O4 + 3H2SO4= 2MnSO4 + 10CO2 + 8H2O,在其他操作均正确的情况下,所测得草酸溶液的浓度将____________(填偏大或偏小)。