某同学按照课本实验要求,用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的NaOH 溶液在右图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算中和热。下列说法中,正确的是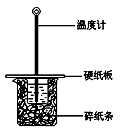
| A.实验过程中没有热量损失 |
| B.图中实验装置缺少环形玻璃搅拌棒 |
| C.烧杯间填满碎纸条的作用是固定小烧杯 |
| D.若将盐酸体积改为60 mL,理论上所求中和热不相等 |
某同学按照课本实验要求,用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的NaOH 溶液在右图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算中和热。下列说法中,正确的是
| A.实验过程中没有热量损失 |
| B.图中实验装置缺少环形玻璃搅拌棒 |
| C.烧杯间填满碎纸条的作用是固定小烧杯 |
| D.若将盐酸体积改为60 mL,理论上所求中和热不相等 |