(1)已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 |
HSCN |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数 |
1.3×10—1 |
1.8×10—5 |
4.9×10—10 |
K1=4.3×10—7 K2=5.6×10—11 |
①25℃时,将20mL0.1mol/LCH3COOH溶液和20mL0.1mol/LHSCN溶液分别与20mL 0.1mol/LNaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:
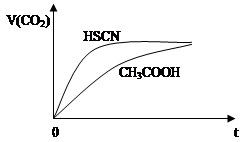
反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是:________________.
反应结束后所得两溶液中,c(SCN—) c(CH3COO—)(填“>”、“<”或“=”)
②若保持温度不变,,下列量会变小的是______________(填序号)
a.c(CH3COO-) b.c(H+) c.Kw d.醋酸电离平衡常数
(2)若往20mL0.1mol/L的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如右图所示,下列有关说法正确的是_______________。
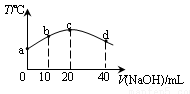
①该烧碱溶液的浓度为0.02mol·L-1
②该烧碱溶液的浓度为0.01mol·L-1
③HNO2的电离平衡常数:b点>a点
④从b点到c点,混合溶液中一直存在:c(Na+)>c(NO2-)>c(OH-)>c(H+)
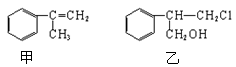
 )反应生成化合物X(立体对称图形),如下图所示:
)反应生成化合物X(立体对称图形),如下图所示: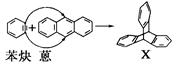
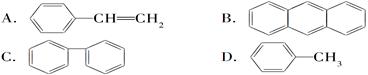
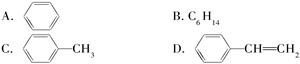

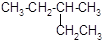 的系统命名为。
的系统命名为。 C6H12O6+6O2
C6H12O6+6O2 CH3OH +H2O
CH3OH +H2O CH2==CH2 + 4H2O
CH2==CH2 + 4H2O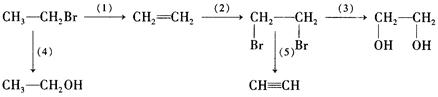
 粤公网安备 44130202000953号
粤公网安备 44130202000953号