化学工作者从有机反应:RH+Cl 2(g)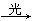 RCl(l)+HCl(g)受到启发,提出的在农药和有机合成工业中可获得副产品盐酸的设想已成为现实。试指出从上述反应产物中分离得到盐酸的最佳方法是(提示:g表示气态物质,l表示液态物质。HCl极易溶于水得到盐酸。RCl是有机物难溶于水。)
RCl(l)+HCl(g)受到启发,提出的在农药和有机合成工业中可获得副产品盐酸的设想已成为现实。试指出从上述反应产物中分离得到盐酸的最佳方法是(提示:g表示气态物质,l表示液态物质。HCl极易溶于水得到盐酸。RCl是有机物难溶于水。)
| A.蒸馏法 | B.升华法 | C.水洗分液法 | D.有机溶剂萃取法 |
化学工作者从有机反应:RH+Cl 2(g)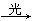 RCl(l)+HCl(g)受到启发,提出的在农药和有机合成工业中可获得副产品盐酸的设想已成为现实。试指出从上述反应产物中分离得到盐酸的最佳方法是(提示:g表示气态物质,l表示液态物质。HCl极易溶于水得到盐酸。RCl是有机物难溶于水。)
RCl(l)+HCl(g)受到启发,提出的在农药和有机合成工业中可获得副产品盐酸的设想已成为现实。试指出从上述反应产物中分离得到盐酸的最佳方法是(提示:g表示气态物质,l表示液态物质。HCl极易溶于水得到盐酸。RCl是有机物难溶于水。)
| A.蒸馏法 | B.升华法 | C.水洗分液法 | D.有机溶剂萃取法 |