溶液中的化学反应大多是离子反应。根据要求回答下列问题。
(1)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,试用化学方程式表示:
盐碱地产生碱性的原因:_______________;
(2)已知水存在如下平衡:H2O+H2O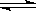 H3O++OH-,向水中加入NaHSO4固体,水的电离平衡向________移动,且所得溶液显________性。
H3O++OH-,向水中加入NaHSO4固体,水的电离平衡向________移动,且所得溶液显________性。
(3)若取pH、体积均相等的NaOH溶液和氨水分别用水稀释m倍、n倍,稀释后pH仍相等,则m________(填“>”、“<”或“=”)n。
(4)常温下,在pH=6的CH3COOH与CH3COONa的混合溶液中水电离出来的c(OH-)=______。
(5)在下图中画出用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 mol·L-1盐酸的滴定曲线示意图。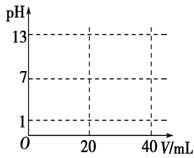
 5NaC1+NaC1O3+3H2O,先往-5℃的NaOH溶液中通入适量C12,然后将溶液加热,溶液中主要阴离子浓度随温度的变化如右图所示,图中C表示的离子是 。
5NaC1+NaC1O3+3H2O,先往-5℃的NaOH溶液中通入适量C12,然后将溶液加热,溶液中主要阴离子浓度随温度的变化如右图所示,图中C表示的离子是 。



 HCOOCH3(g)+2H2(g) △H>0
HCOOCH3(g)+2H2(g) △H>0



 粤公网安备 44130202000953号
粤公网安备 44130202000953号