如图所示,两个连通容器用活塞分开,左右两室(体积相同)各充入一定量NO和O2,且恰好使两容器内气体密度相同。打开活塞,使NO与O2充分反应。(不考虑NO2与N2O4的转化)
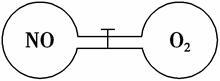
(1)开始时左右两室分子数 (填“相同”或“不相同”)。
(2)反应前后NO室压强 (填“增大”或“减小”) 。
(3)最终容器内密度与原来 (填“相同”或“不相同”)。
(4)最终容器内 (填“有”或“无”)O2存在。
如图所示,两个连通容器用活塞分开,左右两室(体积相同)各充入一定量NO和O2,且恰好使两容器内气体密度相同。打开活塞,使NO与O2充分反应。(不考虑NO2与N2O4的转化)

(1)开始时左右两室分子数 (填“相同”或“不相同”)。
(2)反应前后NO室压强 (填“增大”或“减小”) 。
(3)最终容器内密度与原来 (填“相同”或“不相同”)。
(4)最终容器内 (填“有”或“无”)O2存在。