硫酸亚铁铵是一种浅蓝绿色晶体,俗称摩尔盐。其化学式为:FeSO4•(NH4)2SO4•6H2O硫酸亚铁在空气中易被氧化,而形成摩尔盐后就稳定了。硫酸亚铁铵可由硫酸亚铁与硫酸铵等物质的量混合制得。三种盐的溶解度(单位为g/100g水)如下表:
| 温度/℃ |
10 |
20 |
30 |
40 |
50 |
70 |
| (NH4)2SO4 |
73.0 |
75.4 |
78.0 |
81.0 |
84.5 |
91.9 |
| FeSO4•7H2O |
40.0 |
48.0 |
60.0 |
73.3 |
- |
- |
| 摩尔盐 |
18.1 |
21.2 |
24.5 |
27.9 |
31.3 |
38.5 |
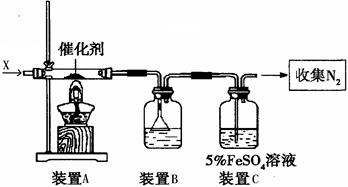
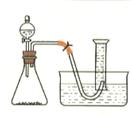
如图是模拟工业制备硫酸亚铁铵晶体的实验装置

回答下列问题:
Ⅰ.(1)先用30%的氢氧化钠溶液煮沸废铁屑(含少量油污、铁锈、FeS等),再用清水洗净,用氢氧化钠溶液煮沸的目的是 。将处理好的铁屑放入锥形瓶中,加入稀硫酸,锥形瓶中发生反应的离子方程式可能为 (填序号)
A.Fe + 2H+=Fe2+ +H2↑ B.Fe2O3+6H+=2Fe3++3H2O
C.2Fe3++H2S=2Fe2++S↓+2H+ D.2Fe3++Fe=3Fe2+
(3)利用容器②的反应,向容器①中通入氢气,应关闭活塞 ,打开活塞 (填字母)。容器③中NaOH溶液的作用是 ;向容器①中通人氢气的目的是 。
Ⅱ.待锥形瓶中的铁屑快反应完时,关闭活塞B、C,打开活塞A,继续产生的氢气会将锥形瓶中的硫酸亚铁(含极少部分未反应的稀硫酸)压到饱和硫酸铵溶液的底部。在常温下放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵。硫酸亚铁与硫酸铵溶液混合就能得到硫酸亚铁铵晶体,其原因是 ;从容器①中分离并得到纯净硫酸亚铁铵晶体的操作方法是 。
Ⅲ.制得的硫酸亚铁铵晶体中往往含有极少量的Fe3+,为测定晶体中Fe2+的含量,称取一份质量为20.0g的硫酸亚铁铵晶体样品,制成溶液。用0.5mo1/LKMnO4溶液滴定,当溶液中Fe2+全部被氧化,MnO‾4被还原成Mn2+时,耗KMnO4溶液体积20.00mL.滴定时,将KMnO4溶液装在 (填酸式或碱式)滴定管中,判断反应到达滴定终点的现象为 ;晶体中FeSO4的质量分数为 。
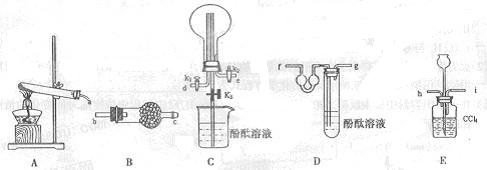
 入一种固体试剂,该试剂的名称为_________,B中能产生氨气和氧气混合气体的原
入一种固体试剂,该试剂的名称为_________,B中能产生氨气和氧气混合气体的原 因(结合化学方程式回答)___。
因(结合化学方程式回答)___。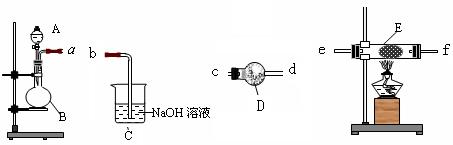
 4NO2(g);△H>0,下表为反应在某温度下的部分实验数据:
4NO2(g);△H>0,下表为反应在某温度下的部分实验数据: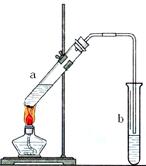
 浓硫酸、冰醋酸和乙醇各2mL,正确的加入顺序及操作是。
浓硫酸、冰醋酸和乙醇各2mL,正确的加入顺序及操作是。 发生暴沸,在加热前应采取的措施是。[
发生暴沸,在加热前应采取的措施是。[ (1)甲同学在气体入口处通入CO和CO2的混合气体,E内放置CuO,并选择其他合适装置获得了纯净干燥的CO,验证了CO的还原性及氧化产物。该同学所选装置的连接顺序为A→() → () →() → () →()(填代号、下同)。能验证CO氧化产物的现象是。
(1)甲同学在气体入口处通入CO和CO2的混合气体,E内放置CuO,并选择其他合适装置获得了纯净干燥的CO,验证了CO的还原性及氧化产物。该同学所选装置的连接顺序为A→() → () →() → () →()(填代号、下同)。能验证CO氧化产物的现象是。
 O2
O2 粤公网安备 44130202000953号
粤公网安备 44130202000953号