(1)人们常用催化剂来选择反应进行的方向。下图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。
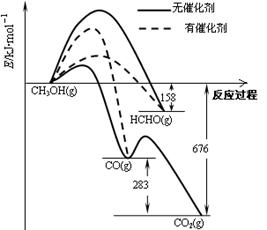
①在有催化剂作用下,CH3OH与O2反应主要生成 (填“CO、CO2” 或“HCHO”)。2HCHO(g)+O2(g)=2CO(g)+2H2O(g)△H= 。
②甲醇制取甲醛可用Ag作催化剂,含有AgCl会 影响Ag催化剂的活性。用氨水可以溶解除去其中的AgCl,写出该反应的离子方程式: 。
(2)已知:CO(g)+ 2H2(g) CH3OH(g)△H =" -a" kJ•mol-1。
CH3OH(g)△H =" -a" kJ•mol-1。
①经测定不同温度下该反应的平衡常数如下:
温度(℃)
|
250
|
300
|
350
|
K
|
2.041
|
0.270
|
0.012
|
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO)="0.4" mol·L-1、c(H2)="0.4" mol·L-1、c(CH3OH)="0.8" mol·L-1,则此时v正 v逆(填“>”、“<”或“=”)。
②某温度下,在体积固定的2L的密闭容器中将1 mol CO和2 mol H2混合,测得不同时刻的反应前后压强关系如下:
时间(min)
|
5
|
10
|
15
|
20
|
25
|
30
|
压强比(P后/P前)
|
0.98
|
0.90
|
0.80
|
0.70
|
0.70
|
0.70
|
则0~15 min,用H2表示的平均反应速率为 ,达到平衡时CO的转化率为 。
(3)利用钠碱循环法可除去SO2,消除SO2对环境的污染。吸收液吸收SO2的过程中,pH随n(SO3²-)∶n(HSO3-)变化关系如下表:
n(SO3²-)∶n(HSO3-)
|
91∶9
|
1∶1
|
1∶91
|
pH
|
8.2
|
7.2
|
6.2
|
根据上表判断NaHSO3溶液显 性。
② 在NaHSO3溶液中离子浓度关系正确的是 (填字母)。
a. c(Na+)> c(HSO3-)> c(H+)> c(SO32-)> c(OH-)
b. c(Na+)= 2c(SO32-)+ c(HSO3-)
c. c(H2SO3)+ c(H+)= c(SO32-)+ (OH-)
d. c( Na+)+ c(H+)= c(SO32-)+ c(HSO3-)+ c(OH-)

