请根据表中数据回答有关问题:
| 酸或碱 |
电离常数(Ka或Kb) |
难(微)溶物 |
溶度积常数 |
| CH3COOH |
1.8×10-5 |
BaSO4 |
1×10-10 |
| HNO2 |
4.6×10-4 |
BaCO3 |
2.6×10-9 |
| HCN |
5×10-10 |
CaSO4 |
7×10-5 |
| HClO |
3×10-8 |
|
|
| NH3·H2O |
1.8×10-5 |
|
|
(1)表中所列四种酸中,酸性最弱的是 (用化学式表示)。下列能使醋酸溶液中CH3 COOH的电离度增大,而电离常数不变的操作是 (填序号);
A.升高温度 B.加水稀释
C.加少量的CH3 COONa固体 D.加少量冰醋酸
(2)已知纯水在100℃时的pH=6。该温度下0. lmol/L的NaOH溶液中,pH为 ;
(3)常温下,向水中加入少量醋酸铵固体,所得溶液呈中性,简述其原因 ;
(4)工业中制BaCl2时,需先将BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,欲使SO42-物质的量浓度达到0.01 mol/L以上,则溶液中CO32-物质的量浓度应≥_______mol/L;
 、Mg2+、
、Mg2+、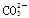 、Ba2+、
、Ba2+、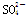 ,若将该混合物溶于水可得澄清溶液,现取3份各100 mL该溶液分别进行如下实验:
,若将该混合物溶于水可得澄清溶液,现取3份各100 mL该溶液分别进行如下实验:


 粤公网安备 44130202000953号
粤公网安备 44130202000953号