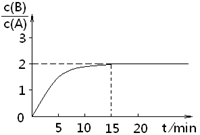
某温度下在2L密闭容器中加人一定量A,发生以下化学反应:2A(g) 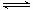 B(g)+C(g);ΔH =-48.25kJ/mol。反应过程中B、A的浓度比与时间t有右图所示关系,若测得第15min时c(B)=1.6mol/L,下列结论正确的是
B(g)+C(g);ΔH =-48.25kJ/mol。反应过程中B、A的浓度比与时间t有右图所示关系,若测得第15min时c(B)=1.6mol/L,下列结论正确的是
A.该温度下此反应的平衡常数为3.2
B.A的初始物质的量为4mol
C.反应到达平衡时,放出的热量是193kJ
D.反应达平衡时,A的转化率为80%
某温度下在2L密闭容器中加人一定量A,发生以下化学反应:2A(g) 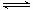 B(g)+C(g);ΔH =-48.25kJ/mol。反应过程中B、A的浓度比与时间t有右图所示关系,若测得第15min时c(B)=1.6mol/L,下列结论正确的是
B(g)+C(g);ΔH =-48.25kJ/mol。反应过程中B、A的浓度比与时间t有右图所示关系,若测得第15min时c(B)=1.6mol/L,下列结论正确的是

A.该温度下此反应的平衡常数为3.2
B.A的初始物质的量为4mol
C.反应到达平衡时,放出的热量是193kJ
D.反应达平衡时,A的转化率为80%