现有含NaCl、Na2SO4和NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-和NO3-的相互分离。相应的实验过程可用下图表示:
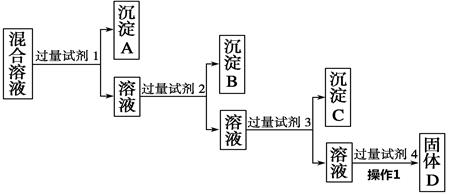
(1)写出下列物质的化学式:试剂1________,试剂2________,试剂4________,沉淀C 。
(2)加入过量试剂3的目的是__________________。
(3)在加入试剂4后,获得固体D的实验操作1分别是 、 、过滤(填操作名称)。
现有含NaCl、Na2SO4和NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-和NO3-的相互分离。相应的实验过程可用下图表示:

(1)写出下列物质的化学式:试剂1________,试剂2________,试剂4________,沉淀C 。
(2)加入过量试剂3的目的是__________________。
(3)在加入试剂4后,获得固体D的实验操作1分别是 、 、过滤(填操作名称)。