(实验班做)合成氨工业中氢气可由天然气和水蒸汽反应制备,其主要反应为:
CH4+ 2H2O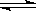 CO2+4H2,已知:
CO2+4H2,已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890KJ/mol
2H2(g)+O2(g)=2H2O(l) △H=-571.6KJ/mol
H2O(g)=H2O(l) △H=-44KJ/mol
(1)写出由天然气和水蒸汽反应制备H2的热化学方程式: 。
(2)某温度下,10L密闭容器中充入2mol CH4和3mol H2O(g),发生CH4(g)+ 2H2O(g) 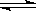 CO2(g)+4H2(g)反应,过一段时间反应达平衡,平衡时容器的压强是起始时的1.4倍。
CO2(g)+4H2(g)反应,过一段时间反应达平衡,平衡时容器的压强是起始时的1.4倍。
则①平衡时,CH4的转化率为 ,H2的浓度为 ,反应共放出或吸收热量 KJ。
②升高平衡体系的温度,混合气体的平均相对分子质量 ,密度 。(填“变大”“变小”或“不变”)。
③当达到平衡时,充入氩气,并保持压强不变,平衡将 (填“正向”“逆向”或“不”)移动。
④若保持恒温,将容器压缩为5L(各物质仍均为气态),平衡将 (填“正向”“逆向”或“不”)移动。达到新平衡后,容器内H2浓度范围为 。
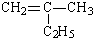 :__________________。
:__________________。 的名称 _______________________________________
的名称 _______________________________________
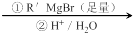
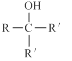


 粤公网安备 44130202000953号
粤公网安备 44130202000953号