以锌铜合金的废料为原料制备硫酸铜晶体(CuSO4·5H2O)的部分工艺流程如图所示:
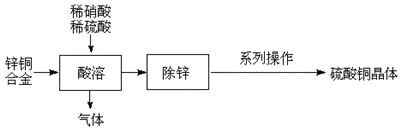
(1)酸溶时,铜转化为Cu2+的离子方程式为 ,锌铜合金要剪成碎片且反应过程要不断搅拌,其目的是 。
(2)为使酸溶后的溶液中不含NO3-,配制混酸稀溶液时,应控制硫酸与硝酸的物质的量之比不小于 。
(3)“系列操作”为 、 、过滤、洗涤、干燥。
(4)测定除锌后的溶液中Cu2+离子浓度的方法为:准确量取V1mL除锌后的溶液于锥形瓶中,调节pH=3~4,加入过量KI,充分反应后,滴加2滴淀粉溶液,再慢慢滴加c mol/L Na2S2O3标准溶液至恰好完全反应,消耗Na2S2O3标准溶液V2 mL。已知: 2Cu2++4I-=2CuI↓+I2 2S2O32-+I2=S4O62-+2I-
①“恰好反应”时溶液的颜色变化为 。
②Cu2+离子的物质的量浓度为 mol/L(用V1、V2、c表示)。
③若除锌后的溶液中仍含有NO3-离子,则测定结果会 (填“偏大”、“偏小”、“无影响”)。


 粤公网安备 44130202000953号
粤公网安备 44130202000953号