(1)室温下,Ksp(BaSO4)=1.1×10-10,将pH=9 的 Ba(OH)2溶液与 pH=4 的 H2SO4溶液混合,若所得混合溶液的 pH=7,则 Ba(OH)2溶液与 H2SO4溶液的体积比为 。欲使溶液中c(SO42-)≤1.0×10-5mol·L-1,则应保持溶液中 c(Ba2+) ≥ mol·L-1。
(2)一定温度下,向1 L 0.1 mol·L-1CH3COOH溶液中加入0.1 molCH3COONa固体,则醋酸的电离平衡向 (填“正”或“逆”)反应方向移动;溶液中 的值 (填“增大”、“减小”或“不变”)。
的值 (填“增大”、“减小”或“不变”)。
(3)已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5
b.CH3COOH+NaHCO3 = CH3COONa+CO2↑+H2O 室温下,CH3COONH4溶液呈 性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈 性。NH4HCO3溶液中物质的量浓度最大的离子是 (填化学式)。
 mol·L-l NaOH溶液至20.00 mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3 mol·L-l H2S04溶液酸化后,用0.10 mol·L-l KMnO4溶液滴定,当消耗KMnO4溶液16.00 mL时,溶液由无色变为浅紫红色。请回答下列问题:
mol·L-l NaOH溶液至20.00 mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3 mol·L-l H2S04溶液酸化后,用0.10 mol·L-l KMnO4溶液滴定,当消耗KMnO4溶液16.00 mL时,溶液由无色变为浅紫红色。请回答下列问题:
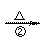
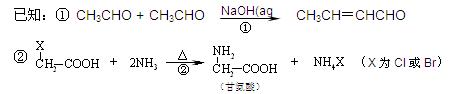
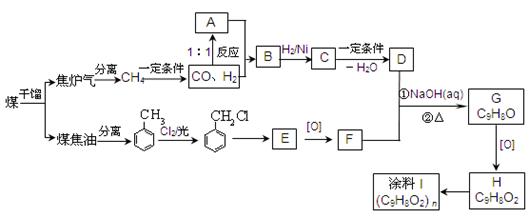
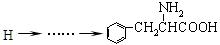 H的合成路线并注明反应条件。
H的合成路线并注明反应条件。
 2NH3(g)△H=一92 kJ/mol。为提高氢气的转化率,宜采取的措施有。(填字母)
2NH3(g)△H=一92 kJ/mol。为提高氢气的转化率,宜采取的措施有。(填字母)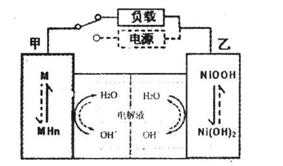

 坡或刹车时,甲电极的电极反应式为_______;混合动力车上坡或加速时,乙电极的电极反应式为_________________。
坡或刹车时,甲电极的电极反应式为_______;混合动力车上坡或加速时,乙电极的电极反应式为_________________。 CO2(g)。
CO2(g)。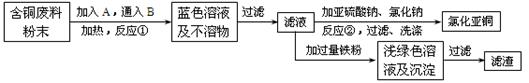
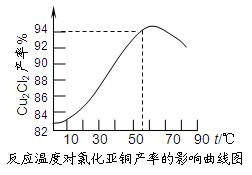
 粤公网安备 44130202000953号
粤公网安备 44130202000953号