下面是以化合物I为原料合成一种香精(化合物Ⅵ)的合成路线,反应在一定条件下进行。化合物Ⅵ广泛用于香精的调香剂。
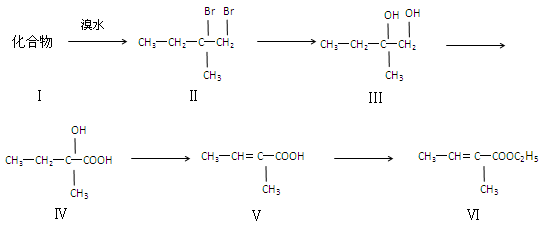
回答下列问题:
(1)化合物Ⅰ生成化合物Ⅱ的反应原子利用率可达100%,化合物Ⅰ的结构简式为,该化合物核磁共振氢谱中有______个吸收峰。
(2)化合物Ⅱ生成化合物Ⅲ发生反应,其方程式为____________________(注明反应条件)。
(3)化合物Ⅴ有多种同分异构体。请写出与化合物Ⅴ官能团种类相同且无支链的所有同分异构体的结构简式_________________
(4)化合物Ⅵ不能发生的反应类型是(填字母)。
| A.加成反应 |
B.酯化反应 |
C.水解反应 |
D.加聚反应 |
(5)写出化合物Ⅵ在一定条件下反应,生成高分子化合物的化学方程式:(不需注明条件)。