下面列出了几组物质,请将物质的合适序号填写在横线上。
① O2和O3 ② CH3CH3和CH3CH2CH2CH3 ③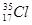 和
和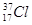
④ CH3CH(CH3)CH2CH3和C(CH3)4 
(1) 属于同位素的是: (2) 属于同素异形体的是:
(3) 属于同系物的是: (4) 属于同分异构体的是:
(5) 属于同一物质: 。
下面列出了几组物质,请将物质的合适序号填写在横线上。
① O2和O3 ② CH3CH3和CH3CH2CH2CH3 ③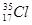 和
和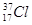
④ CH3CH(CH3)CH2CH3和C(CH3)4 
(1) 属于同位素的是: (2) 属于同素异形体的是:
(3) 属于同系物的是: (4) 属于同分异构体的是:
(5) 属于同一物质: 。