某混合溶液中,可能大量含有的离子如下表: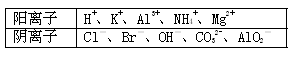
为探究其成分,某同学将Na2O2逐渐加入到上述混合溶液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系分别如下图所示: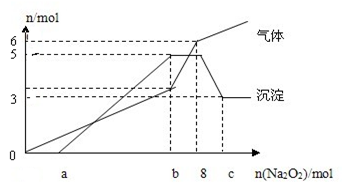
(1)该溶液中一定含有的阳离子是___________,其对应物质的量浓度之比为________,溶液中一定不存在的阴离子是_____________;
(2)请写出沉淀减少的离子方程式___________________。
某混合溶液中,可能大量含有的离子如下表:
为探究其成分,某同学将Na2O2逐渐加入到上述混合溶液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系分别如下图所示:
(1)该溶液中一定含有的阳离子是___________,其对应物质的量浓度之比为________,溶液中一定不存在的阴离子是_____________;
(2)请写出沉淀减少的离子方程式___________________。