(14分)氨的合成是最重要的化工生产之一。
Ⅰ.工业上合成氨用的H2有多种制取的方法:
①用焦炭跟水反应:C(s)+H2O(g) CO(g) + H2(g);
CO(g) + H2(g);
②用天然气跟水蒸气反应:CH4(g)+H2O(g)  CO(g)+3H2(g)
CO(g)+3H2(g)
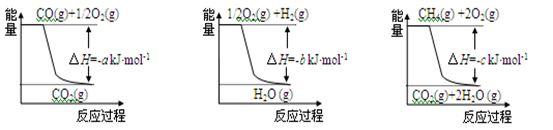
已知有关反应的能量变化如下图,且方法②的反应为吸热反应,则方法②中反应的ΔH =________kJ/moL。
Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:
3H2(g)+N2(g) 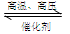 2NH3(g)
2NH3(g)
按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
| 容 器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
3 mol H2、2 mol N2 |
6 mol H2、4mol N2 |
2 mol NH3 |
| 达到平衡的时间(min) |
t |
5 |
8 |
| 平衡时N2的浓度(mol·L-1) |
c1 |
3 |
c2 |
(1)下列能说明该反应已达到平衡状态的是 。
a.容器内N2、H2、NH3的浓度之比为1︰3︰2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(2)甲容器中达到平衡所需要的时间t 5min,表中c1 c2(填“>”、“<” 或“=”)。
(3)用氨合成尿素的反应为2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g)。工业生产时,原料气带有水蒸气。图1表示CO2的转化率与氨碳比
CO(NH2)2(s)+H2O(g)。工业生产时,原料气带有水蒸气。图1表示CO2的转化率与氨碳比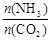 、水碳比
、水碳比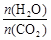 的变化关系。
的变化关系。
①曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是 。
②测得B点氨的转化率为30%,则x1= 。
Ⅲ.有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图2所示。
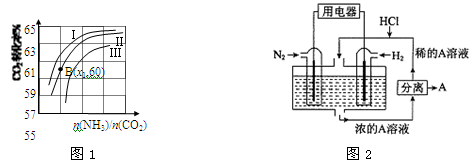
电池正极的电极反应式是 ,A是 。

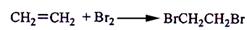 。可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如图所示。回答下列问题:
。可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如图所示。回答下列问题: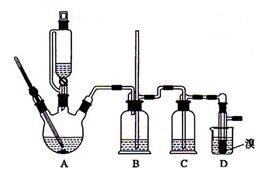


 粤公网安备 44130202000953号
粤公网安备 44130202000953号