某同学设计由G(CH3CH2OH)合成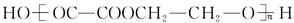 的合成路线如下:[( )内为反应类型,
的合成路线如下:[( )内为反应类型, 内为目标产物]
内为目标产物]
①写出反应类型:a________,b________;
②写出 内物质的结构简式:Ⅰ______________,Ⅱ______________。
内物质的结构简式:Ⅰ______________,Ⅱ______________。
③写出Ⅱ→Ⅲ的化学反应方程式 。
④Ⅲ与Ⅵ反应合成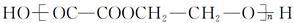 的化学方程式 。
的化学方程式 。
某同学设计由G(CH3CH2OH)合成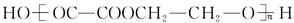 的合成路线如下:[( )内为反应类型,
的合成路线如下:[( )内为反应类型, 内为目标产物]
内为目标产物]
①写出反应类型:a________,b________;
②写出 内物质的结构简式:Ⅰ______________,Ⅱ______________。
内物质的结构简式:Ⅰ______________,Ⅱ______________。
③写出Ⅱ→Ⅲ的化学反应方程式 。
④Ⅲ与Ⅵ反应合成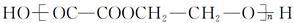 的化学方程式 。
的化学方程式 。