(15分)某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程脱除燃煤尾气中的SO2,同时制得电池材料MnO2(反应条件已省略)。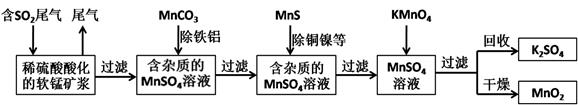
请回答下列问题:
(1)上述流程中多次涉及到过滤操作,实验室进行过滤操作时需要用到的硅酸盐仪器有玻璃棒、 、 ;其中玻璃棒的作用是 。
(2)用MnCO3能除去溶液中的Al3+和Fe3+,其原理是 。
(3)已知Ksp(CuS)=8.4×10-45,Ksp(NiS)=1.4×10-24;在除铜镍的过程中,当Ni2+恰好完全沉淀 (此时溶液中c(Ni2+)=1.0×10-5mol/L),溶液中Cu2+的浓度是 mol/L。
(4)工业上采用电解K2MnO4水溶液的方法来生产KMnO4,其中惰性电极作阳极,铁作阴极,请写出阳极的电极反应式 。
(5)下列各组试剂中,能准确测定一定体积燃煤尾气中SO2含量的是_________。(填编号)
a.NaOH溶液、酚酞试液 b.稀H2SO4酸化的KMnO4溶液
c.碘水、淀粉溶液 d.氨水、酚酞试液
(6)除杂后得到的MnSO4溶液可以通过 制得硫酸锰晶体。(MnSO4•H2O,相对分子质量为169)
a.过滤
b.蒸发浓缩
c.冷却结晶
d.灼烧
e.干燥
(7)已知废气中SO2浓度为8.4 g/m3,软锰矿浆对SO2的吸收率可达90%,则处理1000 m3燃煤尾气,可得到硫酸锰晶体质量为 kg(结果保留3位有效数字)。



 左右时升华。某化学兴趣小组利用下列装置(有些装置可重复使用)设计实验制备并收集无水三氯化铁。
左右时升华。某化学兴趣小组利用下列装置(有些装置可重复使用)设计实验制备并收集无水三氯化铁。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号