某化学兴趣小组用铁矿石(主要成分为Fe2O3,还有SiO2、A12O3等杂质)提取Fe2O3。操作讨程如下: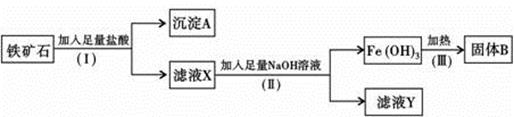
(1)(I)和(Ⅱ)步骤中分离溶液和沉淀的操作名称是 ;
(2)沉淀A中主要含有 ,固体B是 ;
(3)取少量滤液X于试管中滴入几滴KSCN溶液可观察到溶液变成 色,滤液Y中的阴离子除OH-、Cl-外,还有 ;
(4)写出(Ⅱ)步骤中生成Fe(OH)3的离子方程式
某化学兴趣小组用铁矿石(主要成分为Fe2O3,还有SiO2、A12O3等杂质)提取Fe2O3。操作讨程如下:
(1)(I)和(Ⅱ)步骤中分离溶液和沉淀的操作名称是 ;
(2)沉淀A中主要含有 ,固体B是 ;
(3)取少量滤液X于试管中滴入几滴KSCN溶液可观察到溶液变成 色,滤液Y中的阴离子除OH-、Cl-外,还有 ;
(4)写出(Ⅱ)步骤中生成Fe(OH)3的离子方程式