某化学反应的反应物和产物如下:Al+NaNO3+H2 O
O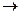 Al(OH)3+N2+NaAlO2
Al(OH)3+N2+NaAlO2
(1)该反应的氧化剂是_____________。(2)该反应的氧化产物是______________。
(3)反应过程中转移5  mol e-,生成标准状况下N2的体积__________ L。
mol e-,生成标准状况下N2的体积__________ L。
(4)配平该反应的化学方程式:
___Al+____NaNO3+___H2O ===______Al(OH)3+____N2+___NaAlO2。
某化学反应的反应物和产物如下:Al+NaNO3+H2 O
O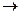 Al(OH)3+N2+NaAlO2
Al(OH)3+N2+NaAlO2
(1)该反应的氧化剂是_____________。(2)该反应的氧化产物是______________。
(3)反应过程中转移5  mol e-,生成标准状况下N2的体积__________ L。
mol e-,生成标准状况下N2的体积__________ L。
(4)配平该反应的化学方程式:
___Al+____NaNO3+___H2O ===______Al(OH)3+____N2+___NaAlO2。