研究性学习小组进行CH4的性质探究实验。
(1)通入高锰酸钾酸性溶液,现象是__ __。
(2)在无色玻璃集气瓶中与Cl2混合后光照,现象是____。
(3)为了验证CH4是否具有还原性,某小组设计了如下实验: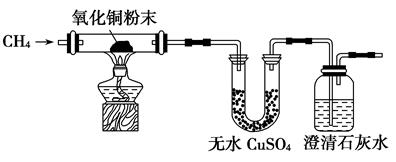
实验过程中还观察到无水CuSO4逐渐变蓝,澄清石灰水出现浑浊现象,则CH4与CuO反应的化学方程式为______。
(4)研究小组将CH4通入溴水时,发现溴水逐渐褪色,你认为原因可能是___ ___。
请设计一个实验方案证明你的结论(用文字表示,不必画实验装置图) ___ ___。
研究性学习小组进行CH4的性质探究实验。
(1)通入高锰酸钾酸性溶液,现象是__ __。
(2)在无色玻璃集气瓶中与Cl2混合后光照,现象是____。
(3)为了验证CH4是否具有还原性,某小组设计了如下实验:
实验过程中还观察到无水CuSO4逐渐变蓝,澄清石灰水出现浑浊现象,则CH4与CuO反应的化学方程式为______。
(4)研究小组将CH4通入溴水时,发现溴水逐渐褪色,你认为原因可能是___ ___。
请设计一个实验方案证明你的结论(用文字表示,不必画实验装置图) ___ ___。