黄铁矿(主要成分FeS2)、黄铜矿(主要成分CuFeS2)均是自然界中的常见矿物资源。
(1)Stumm和Morgan提出黄铁矿在空气中氧化的四步反应如题20图-1所示:
① a反应中每生成1molFeSO4转移电子的物质的量为 mol。
② d反应的离子方程式为 。
(2)用细菌冶铜时,当黄铜矿中伴有黄铁矿可明显提高浸取速率,其原理如题20图-2

①冶炼过程中,正极周围溶液的pH (选填:“增大”、“减小”或“不变”)
②负极产生单质硫的电极反应式为 。
|
(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见下表),其相关反应的平衡常数的对数值与温度的关系如题20图-3。
| 相关反应 |
反应热 |
平衡常数K |
FeS2(s) + H2(g)  FeS(s) + H2S(g) FeS(s) + H2S(g) |
ΔH1 |
K1 |
1/2 FeS2(s) + H2(g) 1/2Fe(s)+H2S(g) 1/2Fe(s)+H2S(g) |
ΔH2 |
K2 |
FeS(s) + H2(g) Fe(s)+H2S(g) Fe(s)+H2S(g) |
ΔH3 |
K3 |

①上述反应中,ΔH1 0(选填:“>”或“<”)。
②提高硫的脱除率可采取的措施有 (举1例)。
③1000K时,平衡常数的对数lgK1、lgK2和lgK3之间的关系为 。



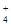 、Fe3+
、Fe3+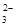 、AlO
、AlO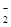
 粤公网安备 44130202000953号
粤公网安备 44130202000953号