利用硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)生产铁基颜料铁黄(FeOOH)的制备流程如下: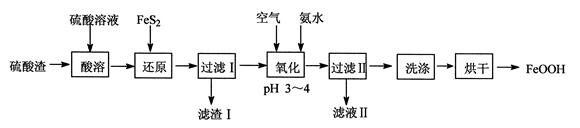
(1)“酸溶”时,Fe2O3与硫酸反应的化学方程式为 。
(2)滤渣Ⅰ的主要成分是FeS2、S和 (填化学式);Fe3+被FeS2还原的离子方程式为 。
(3)“氧化”中,生成FeOOH的离子方程式为 。
(4)滤液Ⅱ中溶质是Al2(SO4)3和 (填化学式);“洗涤”时,检验铁黄表面已洗涤干净的操作是 。
利用硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)生产铁基颜料铁黄(FeOOH)的制备流程如下:
(1)“酸溶”时,Fe2O3与硫酸反应的化学方程式为 。
(2)滤渣Ⅰ的主要成分是FeS2、S和 (填化学式);Fe3+被FeS2还原的离子方程式为 。
(3)“氧化”中,生成FeOOH的离子方程式为 。
(4)滤液Ⅱ中溶质是Al2(SO4)3和 (填化学式);“洗涤”时,检验铁黄表面已洗涤干净的操作是 。