选做[化学—一选修2:化学与技术](15分) 以黄铁矿为原料生产硫酸的工艺流程图如下:
(1)沸腾炉中发生反应的化学方程式为 。
(2)接触室中发生如下反应:2 SO2(g)+O2(g) 2SO3(g) △H=一196.6 kJ·mol-1某研究小组模拟工业生产,在实验室中研究了其他条件不变时,改变某一条件对上述反应的影响.下列分析正确的是 。
2SO3(g) △H=一196.6 kJ·mol-1某研究小组模拟工业生产,在实验室中研究了其他条件不变时,改变某一条件对上述反应的影响.下列分析正确的是 。
a.图I研究的是t0时刻增大O2的浓度对反应速率的影响
b.图Ⅱ研究的是t0时刻加入催化剂对反应速率的影响
c.图Ⅲ研究的是催化剂对平衡的影响,且甲的催化效率比乙高
d.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较低
(3)已知:SO3(g)+H2O(1)=H2SO4(1) ΔH=一130.3 kJ·mol-1。当有6.72×104L(已折算为标准状况下)SO3气体与H2O化合时放出的热量为 (保留两位有效数字)。
(4)依据工艺流程图判断下列说法正确的是 (选填序号字母)。
a.沸腾炉排出的矿渣可供炼铁
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.为使黄铁矿充分燃烧,需将其粉碎
(5)吸收塔吸收SO3用98.3%浓硫酸的原因是 。
(6)某硫酸厂为测定接触室所得气体中S02的体积分数,取280 mL(已折算成标准状况)气体样品与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02 mol·L-1的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00mL。
已知:Cr2O72-+Fe2++H+→Fe3++H2O十Cr3+(未配平)
①SO2通入Fe2(SO4)3溶液中发生反应的离子方程式为 。
②接触室所得气体中SO2的体积分数为 。
 ;请回答下列问题:
;请回答下列问题: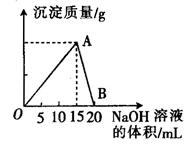

 粤公网安备 44130202000953号
粤公网安备 44130202000953号