向20 mL 某浓度的AlCl3溶液中滴入2 mol·L-1的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示: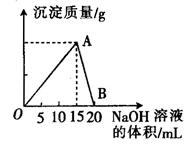
(1)图中A点表示的意义是______________。
(2)最大沉淀量是______________g。
(3)B点表示的意义是______________。
(4)所用AlCl3溶液的物质的量浓度是______________。
(5)当所得沉淀量为0.39克时,用去NaOH溶液的体积是_____ mL 或_______ mL。
向20 mL 某浓度的AlCl3溶液中滴入2 mol·L-1的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:
(1)图中A点表示的意义是______________。
(2)最大沉淀量是______________g。
(3)B点表示的意义是______________。
(4)所用AlCl3溶液的物质的量浓度是______________。
(5)当所得沉淀量为0.39克时,用去NaOH溶液的体积是_____ mL 或_______ mL。