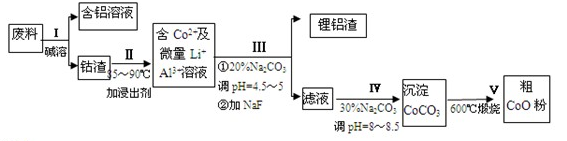
(14分)某化学小组拟利用下列流程测定某草酸亚铁样品(含有少量草酸,不含结晶水和其他杂质)中FeC2O4的含量。
已知几种氢氧化物开始沉淀和完全沉淀的pH如下表所示
| |
Fe2+ |
Fe3+ |
Al3+ |
Mg2+ |
| 开始沉淀时的pH |
7.5 |
2.8 |
4.2 |
9.6 |
| 沉淀完全时的pH |
9.0 |
4.0 |
5 |
11 |
试回答下列问题:
(1)用2 mol/L H2SO4溶液溶解草酸亚铁样品而不用蒸馏水直接溶解的原因是 ,加热至70℃左右,立即用KMnO4溶液滴定至终点。发生反应的离子方程式为2MnO4-+ 5H2C2O4+6H+ =2Mn2++ 10CO2↑+ 8H2O和 。
(2)保温放置30min的目的是 。
(3)证明反应Ⅰ完全的实验操作或现象为 。
(4)已知常温下Fe(OH)3的Ksp=1.1×10-36,废液中c(Fe3+)= mol·L-1。
(5)灼烧充分的标志是 。
(6)样品中FeC2O4的含量为 。


 粤公网安备 44130202000953号
粤公网安备 44130202000953号