【化学—选修3物质结构与性质】(1)A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能(KJ/mol) |
I1 |
I2 |
I3 |
I4 |
| A |
932 |
1821 |
15390 |
21771 |
| B |
738 |
1451 |
7733 |
10540 |
根据上述信息,写出B的基态原子核外电子排布式 ,预测A和氯元素形成的简单分子空间构型为 。
(2)钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,往其中一种配合物的溶液中加入AgNO3溶液时,无明显现象,往其溶液中加BaCl2溶液时若,产生白色沉淀,则该配合物的化学式为 ,中心离子的配位数为 。
(3)参考下表中的物质熔点回答下列问题
| 物质 |
NaF |
NaCl |
NaBr |
NaI |
NaCl |
KCl |
RbCl |
CsCl |
| 熔点(℃) |
995 |
801 |
755 |
651 |
801 |
776 |
715 |
646 |
根据上表数据解释钠的卤化物及碱金属的氯化物的熔点变化规律 。
(4)C60可用作储氢材料。C60的结构如图1。已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确 ,并阐述理由 。科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体,该物质的K原子和C60分子的个数比为 。
(5)三聚氰胺分子的结构简式如图3,则其中氮原子轨道杂化类型是 ,l mol三聚氰胺分子中含 mol 键。
键。
(6)碳化硅的晶胞与金刚石的晶胞相似如图4,设晶胞边长为a cm,碳原子直径为b cm,硅原子直径为c cm,则该晶胞的空间利用率为 (用含a、b、c的式子表示)。
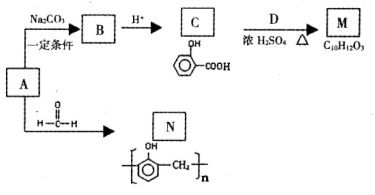
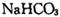 d.
d.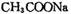

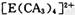 配离子,其中存在的化学键类型有 ______ (填序号);
配离子,其中存在的化学键类型有 ______ (填序号);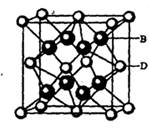
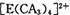 具有对称的空间构型,且当
具有对称的空间构型,且当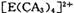 中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则
中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则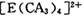 的空间构型为 ____________ (填序号);
的空间构型为 ____________ (填序号);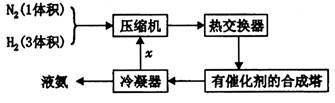
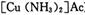 )溶液,以获得纯净原料气。其中,吸收CO的反应为:
)溶液,以获得纯净原料气。其中,吸收CO的反应为: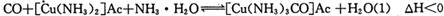
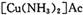 氧化为
氧化为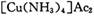 ,则反应中还原剂与氧化剂的物质的量之比是____________;
,则反应中还原剂与氧化剂的物质的量之比是____________;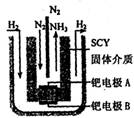
 粤公网安备 44130202000953号
粤公网安备 44130202000953号